Qu’est ce qu’un diagramme de Pourbaix?
Cette section explique la fonction d’un diagramme de Pourbaix et les paramètres qui influence la spéciation d’un élément en solution.
- pH
- Potentiel Redox
Les espèces ioniques peuvent être présentes dans l’eau sous différents états d’oxydation en fonction du potentiel redox du milieu. De plus, pour un même état d’oxydation, le niveau de dissociation d’une espèce varie en fonction du pH. L’arsenic, par exemple, est un métal lourd qui possède plusieurs niveaux d’oxydation (-3, 0, +3, +5) mais qui se présente majoritairement sous les formes arseniate (As⁵⁺) et arsenite (As³⁺) dans les eaux naturelles. Chacune de ces deux formes se décline en différents états de dissociation selon la valeur du pH
L’arseniate (As⁵⁺) se dissocie en fonction du pH selon la réaction séquentielle suivante:
H₃AsO₄ ↔ H₂AsO₄¯ + H⁺ ↔ HAsO₄²¯ + 2H⁺ ↔ AsO₄³¯ + 3H⁺ (1)
L’arsenite (As3⁺) se dissocie en fonction du pH selon la réaction séquentielle suivante:
H₃AsO₃ ↔ H₂AsO₃¯ + H⁺↔ HAsO₃¯ + 2H⁺↔ AsO₃³¯ + 3H⁺ (2)
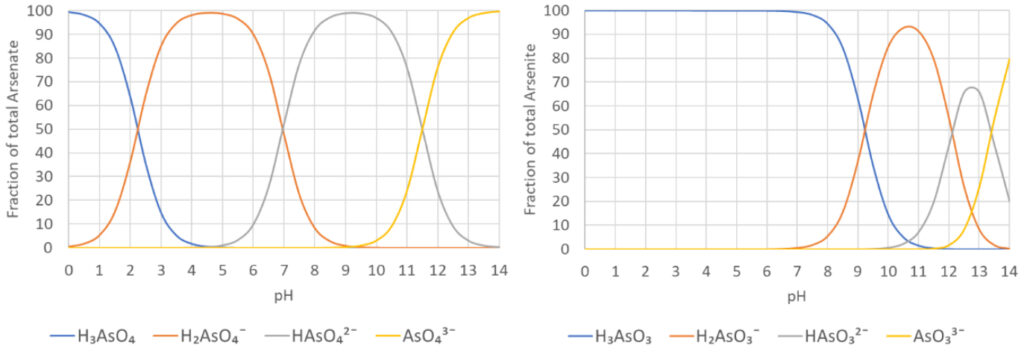
Figure 1 : dissociation de l’Arseniate (As5⁺) en fonction du pH
Figure 2: dissociation de l’Arsénite (As³⁺) en fonction du pH
La figure 1 indique que l’arséniate (As⁵⁺) se dissocie séquentiellement dans l’eau selon l’équation 1. À un pH de 7, les concentrations de H₂AsO₄¯ et HAsO₄²¯ seront presque égales. La charge électrique de l’arséniate est négative (-1 ou -2) à des niveaux de pH compris entre 5 et 7.
La figure 2 montre que l’arsénite (As³⁺) se dissocie également dans l’eau. À un pH de 7, H₃AsO₃ est l’espèce dominante tandis que H₂AsO₃¯ représente une petite fraction (+/-1%) alors que la contribution de HAsO₃²¯ et AsO₃³¯ est insignifiante. Comme la charge électrique de l’arsénite est neutre dans la gamme de pH des eaux naturelles (6-9), cette forme n’est pas facile à éliminer. La conversion en arséniate est un élément essentiel de tout processus de traitement de l’arsenic.
La figure 1 montre que H₂AsO₄¯ est l’espèce dominante de l’arséniate à pH =3. La figure 2 montre que H₃AsO₃ est l’espèce dominante de l’arsénite à pH =3. Le rapport des concentrations arséniate (As⁵⁺)/arsénite (As³⁺) pour différents potentiels redox à pH 3 peut être calculé par l’équation de Nernst. Lorsque ces rapports de concentration d’arséniate (As⁵⁺)/arsénite (As³⁺) sont calculés pour toute la gamme de pH et que nous traçons la concentration à l’équilibre thermodynamique en fonction du pH et du potentiel redox, nous pouvons définir les zones de prédominance des différentes espèces de l’arsenic, comme le montre la figure 3. Ce graphique est appelé le diagramme potentiel – pH ou d’après l’inventeur, le chimiste Marcel Pourbaix (1904-1998).
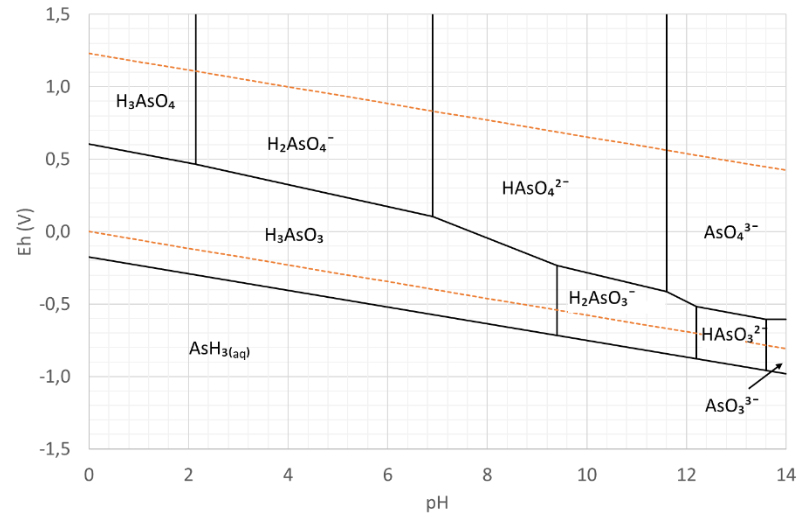
Figure 3 : diagramme de Pourbaix de l’arsenic
Le diagramme de Pourbaix, également connu sous le nom de diagramme potentiel/pH, décrit les phases d’équilibre possibles d’un système électrochimique aqueux. Les lignes du diagramme de Pourbaix décrivent l’état d’équilibre des différentes espèces d’un même élément. Dans les zones situées entre les lignes, l’espèce représentée est prédominante. Outre le potentiel et la valeur du pH, les concentrations d’équilibre dépendent également de facteurs tels que la température, la pression et la concentration de l’élément. Les diagrammes de Pourbaix sont généralement donnés à température ambiante, à pression atmosphérique et à des concentrations molaires de 10¯⁶. La modification de l’un de ces paramètres produit un diagramme différent.
Les diagrammes de Pourbaix sont utilisés, par exemple, dans les études de corrosion, les géosciences et les évaluations environnementales. L’utilisation correcte du diagramme de Pourbaix permet non seulement d’illustrer la nature des espèces présentes dans la solution (ou l’échantillon), mais peut également contribuer à la compréhension des mécanismes de réaction.
Diagramme de Pourbais de l’eau
1) Influence du pH de l’eau
Le pH (potentiel Hydrogène) est une grandeur qui indique la concentration en ion hydronium (H+) d’une solution. Il se calcul selon la formule ci-dessous:
pH = – log (H⁺) (la concentration en ions H+ étant exprimée en moles par litre)
Le pOH est une grandeur qui indique la concentration en ion hydroxydes (OH-) d’une solution. Il se calcul selon la formule ci-dessous:
pOH = – log (OH¯) (la concentration en ions OH- étant exprimée en moles par litre)
L’eau se dissocie en hydronium (H⁺) et hydroxyde (OH¯) selon la réaction suivante
H⁺ + OH¯↔ H₂O
Avec la réaction de dissociation suivante
Kₑ = [H⁺]. [OH¯] (1)
Ke = constante de dissociation de l’eau (10-14)
[H⁺] = Concentration en ions hydroniums dans l’eau (exprimée en moles par litre)
[OH¯] = Concentration en ions hydroxydes dans l’eau (exprimée en moles par litre)
Si on applique le négatif de la valeur logarithmique décimale de chaque terme de l’équation 1, on obtient:
-log (Kₑ) =log [H⁺] + log [OH¯]
-log (10¯¹⁴) =log [H⁺] + log [OH¯]
14 = pH + pOH
à pH 7 nous avons
14 = 7 + pOH
pOH = 7
pH
Si la plage de pH est ajustée de 0 à 14, on obtient
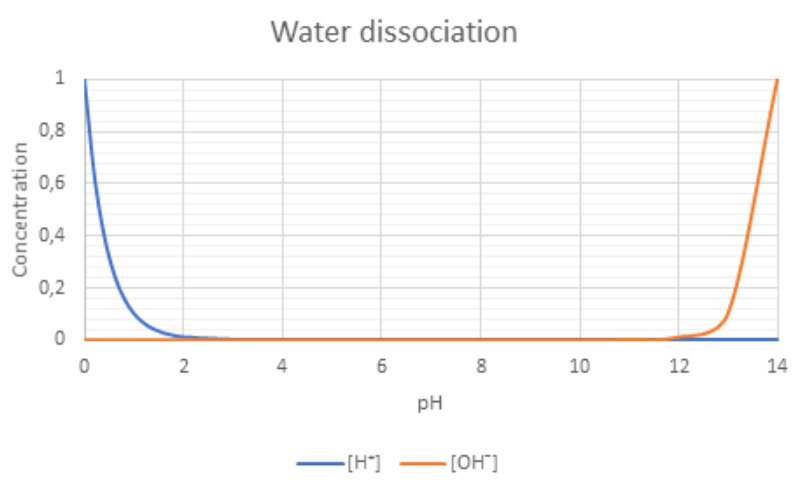
Figure 4: dissociation de l’eau en fonction du pH
Conclusion:
- A des valeurs de pH faibles, les ions hydroniums (H+) prédominent
- A pH neutre, les concentrations en ions hydronium (H+) et hydroxydes (OH-) sont égales.
- A des valeurs de pH élevées, les ionshydroxydes (OH-) prédominent
2) Influence du potentiel redox
Les potentiels redox de l’oxygène et de l’hydrogène sont les suivants:
| Elément | Redox | Espèce stable |
Oxygène | 0 | O₂ |
| -2 | OH¯ |
Hydrogène | +1 | H⁺ |
| 0 | H₂ |
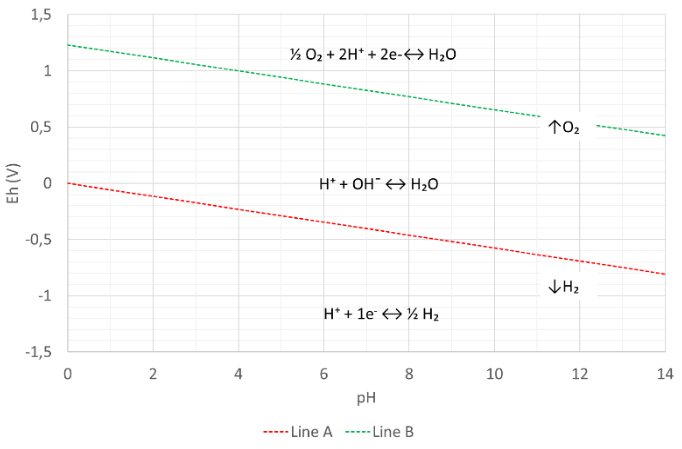
Figure 5 : diagramme de Pourbaix de l’eau
La figure 5 montre le diagramme de Pourbaix de l’eau. Le diagramme comporte deux lignes d’équilibre des espèces
La ligne verte B limite les deux réactions suivantes:
Au dessus de la ligne B: ½ O₂ + 2H⁺ + 2e-↔ H₂O L’état d’oxydation de l’atome d’oxygène = 0
En dessous de la ligne B: H⁺ + OH¯ ↔ H₂O L’état d’oxydation de l’atome d’oxygène = -2
La ligne rouge A limite les deux réactions suivantes:
Au dessus de la ligne A: H⁺ + OH¯ ↔ H₂O L’état d’oxydation de l’atome d’hydrogène (H) = +1
En dessous de la ligne A: H⁺ + 1e- ↔ ½ H₂ L’état d’oxydation de l’atome d’hydrogène (H) = 0
En appliquant la formule de Nerst, nous pouvons effectuer les calculs suivants:
Au dessus de la ligne B: [½O₂] > [OH¯]
Sur la ligne B: [½O₂] = [ OH¯]
En dessous de la ligne B: [½O₂] < [OH¯]
Au dessus de la ligne A: [½H] < [H⁺]
Sur la ligne A: [½H] = [H⁺]
En dessous de la ligne A: [½H] > [H⁺]
Le pH d’une eau naturelle se situe entre 4-9 alors que le potentiel redox varie généralement de 0 à 0.5V.
Les diagrammes de Pourbaix ou de potentiel/pH des différents métaux lourds présents dans l’eau sont utilisés pour définirr les conditions de fonctionnement optimales et le meilleur moyen d’élimination :
- De l’Arsenic
- Du Chrome
- Du Plomb
- Du Mercure
- Du Nickel


